
Znaczna grupa asymetrycznych związków chemicznych występujących na świecie może istnieć w dwóch formach, które – posiadając dokładnie takie same wzory sumaryczne – tworzą swoje odbicia lustrzane, czyli są chiralne. O tym, jakie to ma znaczenie dla świata, opowiada prof. Małgorzata Barańska z Wydziału Chemii UJ, której zespół w ostatnich dniach dokonał znaczących odkryć w dziedzinie wzbudzania chiralności cząstek.
Czym właściwie jest chiralność? Aby lepiej zrozumieć znaczenie tej cechy, spróbujmy wyobrazić sobie lustro. Stawiając przed nim hipotetyczną cząsteczkę, otrzymamy odbicie w pełni odwzorowujące jej budowę. Gdyby jej zwierciadlany wizerunek miał możliwość stanąć obok swojego oryginału, moglibyśmy zaobserwować jedną z dwóch zależności. Wersja pierwsza: zarówno cząsteczka, jak i jej lustrzany pierwowzór są dokładnie takie same, a więc mają symetryczną budowę. Wersja druga: obie cząsteczki postawione „w szeregu” nie pokrywają się ze sobą – lewa strona tej jednej wygląda jak prawa drugiej, itp. Sedno chiralności tkwi właśnie w tej różnicy – o ile w pierwszym wariancie bez względu na to, czy patrzymy na pierwowzór, czy na lustrzane odbicie, cząsteczka wciąż pozostaje wizualnie taka sama, o tyle w drugim mamy do czynienia z enancjomerami, czyli parą molekuł, będących swoimi optycznymi „przeciwnościami”.Prawoskrętny kotlet
Chiralność to zjawisko bardzo często występujące w naturze. W zasadzie cały organizm ludzki zbudowany jest z enancjomerów. Najpopularniejszym przykładem mogą być białka pełniące wiele funkcji w naszym organizmie oraz DNA zawierające kod genetyczny – wyjaśnia prof. Barańska. Właściwie wszystkie aminokwasy, oprócz tego najprostszego (glicyny) są związkami chiralnymi i – co więcej – każdy charakteryzuje się dokładnie tą samą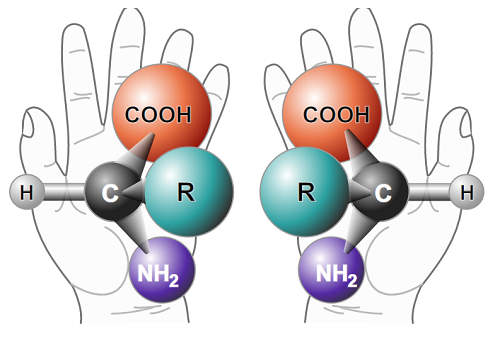 konfiguracją L (grupa aminowa po lewej stronie łańcucha głównego). L-aminokwasy egzogenne są niezbędne do prawidłowego funkcjonowania organizmu, który nie jest ich w stanie wytworzyć sam. Nasuwa się więc pytanie, czy odbicia lustrzane tych substancji również byłyby w stanie spełnić takie funkcje? Moglibyśmy na przykład wyobrazić sobie, albo wręcz zsyntezować białko tylko z D-aminokwasów (grupa aminowa po prawej stronie łańcucha głównego). Wyglądałoby ono bardzo podobnie do swojego „oryginalnego” odpowiednika L. Jedyną i jak się okazuje bardzo ważną różnicą - mimo że nie dostrzegalną gołym okiem - byłby fakt, iż struktura D-białka stałaby się odbiciem lustrzanym L-białka – tłumaczy prof. Barańska. Gdybyśmy jakimś cudem wyhodowali kawałek mięśnia (takie hodowle są już możliwe) bazując tylko na D-białkach i postanowili przygotować z tego mięsa potrawę, okazałoby się, że nie dostarczyłoby nam takich samych wartości odżywczych jak to „normalne”. D-aminokwasy nie zostałyby przechwycone z pożywienia w ten sam sposób jak te z grupy L, gdyż nasz organizm posługujący się różnymi mechanizmami enzymatycznymi (które też są chiralne) „nie rozpoznałby” ich – analizuje pracownik UJ. Podobnie rzecz ma się z cukrami, z których znakomita większość tych pochodzenia naturalnego posiada konfigurację D. Co ciekawe, gdybyśmy posłodzili kawę L-glukozą to co prawda pozostałaby słodka, jednak jej kaloryczność – ze względu, na to, że cukier ten w konfiguracji L wchłania się albo znacznie gorzej, albo wcale – zauważalnie by zmalała.
konfiguracją L (grupa aminowa po lewej stronie łańcucha głównego). L-aminokwasy egzogenne są niezbędne do prawidłowego funkcjonowania organizmu, który nie jest ich w stanie wytworzyć sam. Nasuwa się więc pytanie, czy odbicia lustrzane tych substancji również byłyby w stanie spełnić takie funkcje? Moglibyśmy na przykład wyobrazić sobie, albo wręcz zsyntezować białko tylko z D-aminokwasów (grupa aminowa po prawej stronie łańcucha głównego). Wyglądałoby ono bardzo podobnie do swojego „oryginalnego” odpowiednika L. Jedyną i jak się okazuje bardzo ważną różnicą - mimo że nie dostrzegalną gołym okiem - byłby fakt, iż struktura D-białka stałaby się odbiciem lustrzanym L-białka – tłumaczy prof. Barańska. Gdybyśmy jakimś cudem wyhodowali kawałek mięśnia (takie hodowle są już możliwe) bazując tylko na D-białkach i postanowili przygotować z tego mięsa potrawę, okazałoby się, że nie dostarczyłoby nam takich samych wartości odżywczych jak to „normalne”. D-aminokwasy nie zostałyby przechwycone z pożywienia w ten sam sposób jak te z grupy L, gdyż nasz organizm posługujący się różnymi mechanizmami enzymatycznymi (które też są chiralne) „nie rozpoznałby” ich – analizuje pracownik UJ. Podobnie rzecz ma się z cukrami, z których znakomita większość tych pochodzenia naturalnego posiada konfigurację D. Co ciekawe, gdybyśmy posłodzili kawę L-glukozą to co prawda pozostałaby słodka, jednak jej kaloryczność – ze względu, na to, że cukier ten w konfiguracji L wchłania się albo znacznie gorzej, albo wcale – zauważalnie by zmalała.
Pokaż mi jak pachniesz, a powiem ci… jak skręcasz
Innym ciekawym przykładem jest talidomid – lek, który przepisywany był w latach 50-tych ciężarnym borykającym się z porannymi nudnościami. Właściwościami leczniczymi charakteryzowała się jedynie jego forma prawoskrętna (R-taliomid), natomiast ta zwierciadlana (S-taliomid) w tym konkretnym działaniu pozostawała neutralna. Kobiety dostawały w tabletkach mieszaninę 50%/50% obu enancjomerów. Po pewnym czasie okazało się, że S-talidomid powodował deformację kończyn płodu, zwłaszcza gdy był przyjmowany w pierwszych tygodniach ciąży. Udokumentowano 12 000 takich przypadków – opowiada prof. Barańska. Nasuwa się więc pytanie dlaczego zdecydowano się na stosowanie mieszaniny obu enancjomerów, skoro jedna połowa leku nie posiadała określonego działania? Oczywiście jest to podyktowane względami ekonomicznymi. Synteza dająca mieszaninę racemiczną [tj. obu enancjomerów] jest dużo tańsza – wyjaśnia prof. Barańska. Tego typu przypadków istnieje znacznie więcej. Dla przykładu, przyjmując popularne leki przeciwbólowe dostarczamy do organizmu oba enancjomery ibuprofenu, jednak tylko jeden z nich daje pożądane działanie przeciwbólowe, ten drugi na szczęście jest zupełnie obojętny. Ciekawostką jest również fakt, że enancjomery mogą różnić się także zapachem. Świetnym przykładem w tym przypadku może być karwon (organiczny związek chemiczny), którego enancjomer prawoskrętny charakteryzuje się zapachem mięty, natomiast lewoskrętny – kminku.Leworęczny z piórem w prawej dłoni
Skąd właściwie wzięła się chiralność i dlaczego jest tak powszechna? Jak zawsze, w tej kwestii najwięcej do powiedzenia ma matematyka, a właściwie geometria. Enancjomer posiada zazwyczaj swoje centrum chiralności – może być to na przykład atom węgla, który jest zdolny do przyłączenia kolejnych 4 atomów lub grup atomów. W przypadku, gdy każda z nich wykazuje minimalne różnice, np. w ciężarze, ich rozmieszczenie w przestrzeni może odbyć się tylko na dwa różne sposoby, które zamiast nałożyć się na siebie, stworzą odbicia lustrzane (patrz rysunek poniżej).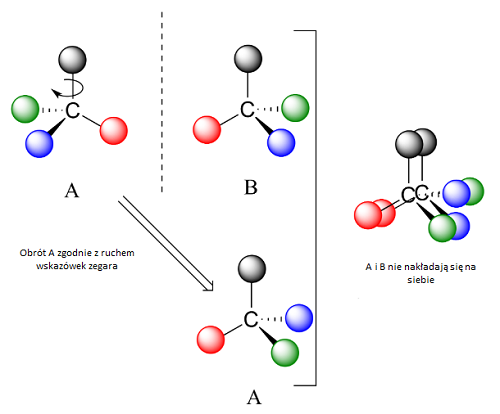
Skoro w takim razie wydaje się to być tak proste, to czy natura wykazuje jakieś preferencje sprzyjając cząsteczce lub związkowi chemicznemu do formowania się w jedno z odbić? I dlaczego właściwie wybrała właśnie L-aminokwasy albo D-cukry, a nie odwrotnie? Dokładnej odpowiedzi jeszcze nie znamy – wyjaśnia prof. Barańska. To co wiemy na pewno to fakt, że w pewnym momencie prawdopodobnie przypadkowy czynnik chiralny wpłynął na taki, a nie inny rozwój świata. Na pewno nie mógłby się on opierać na systemie białek zbudowanych zarówno z jednych jak i drugich aminokwasów – dodaje. Gdyby DNA zbudowane było z obu enancjomerów cukrów (D i L), stworzyłoby to zbyt wiele możliwości i prawdopodobnych ścieżek, po których mogłaby kroczyć ewolucja. A im więcej możliwości, tym więcej błędów, ale to tylko jedna z hipotez – tłumaczy prof. Barańska. Tak więc, dzięki temu, że białka zbudowane są tylko z L-aminokwasów, świat i jego rozwój miał szansę stać się zdecydowanie bardziej uporządkowanym.
A co w sytuacji, kiedy drogi obu enancjomerów skrzyżują się? Jeżeli mamy do czynienia z mieszaniną dwóch enancjomerów 50/50, to ich aktywność optyczna wzajemnie się wyzeruje. Natomiast jeśli będzie niewielki, ale zauważalny nadmiar jednego z enancjomerów, to będziemy w stanie z pomiaru uzyskać sygnał dla niego charakterystyczny. Jednakże, jeśli chodzi o oddziaływanie, to nic specjalnego dziać się nie będzie. W pewnych przypadkach możliwa będzie racemizacja, czyli proces, w którym zbiór cząsteczek jednego enancjomeru, może przekształcić się w mieszaninę racemiczną obu – wyjaśnia prof. Barańska.
Przełomowe wymuszanie
Profesor Barańska wraz ze swoim zespołem zauważyła, że kryształy karoteinowe wyizolowane z korzenia marchwi są chiralne. Nic nadzwyczajnego? Sęk w tym, że w 95% są one zbudowane z beta-karotenu, ten zaś jest związkiem achiralnym, czyli zupełnie identycznym, jak jego lustrzane odbicie. Jak to więc możliwe, że substancja, która nie powinna wykazywać zwierciadlanych różnic, w pewnych warunkach cechowała się tak silną aktywnością optyczną? W naszej pracy pokazaliśmy, że achiralne cząsteczki w sposób uporządkowany tworzą kryształy. Okazało się, że niewielka ilość chiralnego związku spowodowała, że jego pozostałe cząsteczki również stały się aktywne optycznie – wyjaśnia prof. Barańska. Kluczową kwestią w całym zagadnieniu była niemal identyczna struktura obu substancji. Zadziałała tutaj zasada, że podobne oddziałuje z podobnym – dużo trudniej jest „zmusić” omawiane achiralne karotenoidy do bycia chiralnymi, na przykład poprzez oddziaływanie z aktywnym optycznie cukrem o znacząco odbiegającej strukturze. W przypadku, gdy inny chiralny karotenoid tylko w niewielkim stopniu różni się budową od tego achiralnego, interakcja pomiędzy nimi staje się możliwa.
W jaki sposób naukowcom udało się indukować chiralność? Profesor Barańska wyjaśnia, że w odpowiednich warunkach cząsteczki karotenoidów skupiają się ze sobą i tworzą agregaty. Wynika to z prostego faktu, że z energetycznego punktu widzenia dużo korzystniej jest im być ze sobą "w bliskości", niż oddziaływać z rozpuszczalnikiem (podobnie działa również proces krystalizacji). Logiczne jest, że agregaty chiralne tworzone są przez cząsteczki chiralne, natomiast te achiralne – przez karotenoidy achiralne. Okazuje, się jednak, że niewielki dodatek (5%) chiralnego karotenoidu do tego achiralnego spowoduje, że uzyskany agregat wykaże aktywność optyczną o podobnych właściwościach fizycznych (spektroskopowych), jakich spodziewalibyśmy się od 100% chiralnego karotenoidu. I to jest właśnie indukcja chiralności – zaznacza prof. Barańska.
Inna strona wszechświata
Nasuwa się jeszcze jedno pytanie, balansujące nieco na pograniczu fantastyki naukowej – czy jest możliwe stworzenie wszechświata, będącego zwierciadlanym odbiciem tego, w którym funkcjonujemy? Oczywiście, możemy wyobrazić sobie wszechświat, który zbudowany jest z D-aminokwasów i L-cukrów. Co ciekawe nie zauważylibyśmy żadnej różnicy, nawet chiralność obserwowalna w skali makro (muszle ślimaków) nie wpłynęłaby na nasze życie – uspokaja prof. Barańska. W świecie, w którym L-aminokwasy i D-cukry nie byłoby wchłanialne, a R-talidomid a nie S-talidomid byłby szkodliwy, życie płynęłoby swoim torem. Oczywiście jednak tylko przy założeniu, że nie znaleźlibyśmy się "po drugiej stronie lustra" nagle, tylko bytowalibyśmy tam od samego początku. Gdyż w świecie z białkami zbudowanymi z D-aminokwasów i L-cukrów, mieszkańcy naszej rzeczywistej planety nie mieliby co jeść, zaś substancje na co dzień nas otaczające, mające pozytywny lub neutralny wpływ na nasze zdrowie, mogłyby szybko doprowadzić do naszego unicestwienia – podsumowuje prof. Barańska.
------------
Odkrycia związane ze zjawiskiem indukcji chiralności były wynikiem współpracy naukowców z trzech grup badawczych: z Wydziału Chemii Uniwersytetu Jagiellońskiego, z Instytutu Chemii Organicznej PAN w Warszawie oraz z Instytutu Biologii Roślin i Biotechnologii Uniwersytetu Rolniczego w Krakowie.
----------------------
Ciekawe? Przeczytaj także:
- Dlaczego tak trudno znaleźć czterolistną koniczynę?
- Molekularna blokada
- Komórki macierzyste. Science and fiction

![Dwujęzyczność – problem czy błogosławieństwo? [LangUsta cz. 2]](/documents/74541952/141538404/langusta2_230_300.jpg/ba3592d7-7d21-4421-9f11-f4c7a943f19c?t=1558386981480)
![O tym, jak mózg krojąc słowa, przyswaja nowy język [LangUsta cz. I]](/documents/74541952/141538404/langusta_300x230.jpg/d9784af1-55f4-4171-b572-d699dfeb384b?t=1555054714737)

